وبلاگ تفریحی
دانلود آهنگ، دانلود فیلم، دانلود عکس، اس ام اسوبلاگ تفریحی
دانلود آهنگ، دانلود فیلم، دانلود عکس، اس ام اسصحنه آهسته واکنش فلزهای قلیایی با آب
حتماً در آزمایشگاههای شیمی ، واکنش فلزهای قلیایی را با آب مشاهده کردهاید ؛ واکنشی انفجاری که با آزاد شدن گاز هیدروژن و تولید محلول قلیایی همراه است . و حتماً دلیل این انفجار را آزاد شدن سریع گاز هیدروژن میدانید ! nasrollahi5.blogfa.com

اخیراً دانشمندان جمهوری چک ، این واکنش را مورد بازبینی قرار دادهاند . آنها معتقدند که شدت این واکنش به خاطر آزاد شدن گاز هیدروژن نیست ، چراکه پس از تولید اندکی گاز هیدروژن ، یک لایه از گاز و بخار آب بین فلز و آب قرار میگیرد و مانع پیشرفت واکنش میشود . پژوهشگران دلیل سرعت بالای واکنش را « بیثباتی شدید بار الکتریکی » درون فلز میدانند . شیمی دانشی برای همه ی روزگاران
بدین منظور ، این پژوهشگران یک قطعه آلیاژ سدیم- پتاسیم را به درون آب انداختند و انفجار رخ داده را با دوربینی به سرعت 10000 فریم در ثانیه ( 400 بار آهستهتر از زمان واقعی ) مشاهده کردند . آنها دریافتند که پس از 300 میکروثانیه ، ساختارهایی شاخه مانند از آلیاژ فلزی بیرون میزند و لایه بخار اطرافش را سوراخ میکند . این شاخههای ریز ، مساحت سطح آلیاژ را افزایش میدهند و باعث افزایش سرعت واکنش آن با آب میشوند . شیمی دانشی برای همه ی روزگاران
پژوهشگران ، دلیل ظهور این ساختارهای شاخهمانند را فقط و فقط « بار الکتریکی » میدانند . در این واکنش ، الکترونها از فلز به آب منتقل میشوند و فلز بار الکتریکی مثبت پیدا میکند . پژوهشگران با استفاده از شبیهسازی دینامیک مولکولی نشان دادند که به دلیل ظهور این بار مثبت اضافی ، آلیاژ به طور باورنکردنی ناپایدار میشود ؛ لذا این بارهای هم نام ، یکدیگر را دفع میکنند و در پی آن ، یک « انفجار کولونی » رخ میدهد که باعث تولید شاخههای ریز میگردد . nasrollahi5.blogfa.com
منبع : P E Mason et al, Nat. Chem., 2015, DOI: 10.1038/NCHEM.2161
در فیلم زیر ، واکنش آلیاژ سدیم- پتاسیم با آب را با سرعت 10000 فریم در ثانیه ببینید .
دانلود فیلم واکنش آلیاژ سدیم – پتاسیم با آب با سرعت بالا (16/2مگابایت)
آب سنگین چیست؟
S آب سنگین چیست؟
آب سنگین از جدا سازی نوعی از مولکول های آب با غلظت 1 در هر 7000 مولکول به دست می آید که هیدروژن آن یک نوترون بیشتر از هیدروژن عادی دارد.یعنی بجای دواتم هیدروژن درمولکول آب معمولی (H2O )، دواتم هیدروژن سنگین (دوتریم) وجود دارد(D2O).
آب سنگین یکی از مواد اصلی در راه اندازی راکتورهای تولید انرژی و تحقیقاتی موسوم به راکتورهای آب سنگین به شمار می رود. این ماده وظیفه خنک کردن میله های سوخت , همزمان با کند کردن نوترون های پر انرژی را به عهده دارد. نوترون اضافه دراین نوع آب موجب می شود تا عمل کند کنندگی نوترون های پر سرعت به اندازه ای برسد که واکنش های زنجیره ای تولید انرژی از میله های سوخت آغاز شود.
لازم به ذکر است که راکتورهای آب سنگین نیازی به اورانیوم غنی شده ندارند و از اکسید اورانیوم طبیعی به عنوان سوخت استفاده می کنند.
آب چیست؟
آب ماده ای فراوان در کره زمین است. به شکل های مختلفی همچون دریا ، باران ،رودخانه و... دیده میشود. آب در چرخه خود ، مرتباً از حالتی به حالت دیگر تبدیل میشود، اما از بین نمیرود. هر گونه حیات محتاج آب میباشد. انسان ها از آبآشامیدنی استفاده میکنند، یعنی آبی که کیفیت آن مناسب سوخت و ساز بدن باشد.
با رشد جمعیت، منابع آب طبیعی در حال تمام شدن هستند و این مسئله ، سبب نگرانی بسیاری از دولتها در سراسر دنیا شده است. گاهی بدلیل مشکلات کمبود آب ، این ماده را جیره بندی میکنند تا مصرف آن را تعدیل نمایند.
فرمول شیمیایی آب
آب نوعی ماده مرکب است که از دو عنصر اکسیژن و هیدروژن ساخته شده است. آب را جزو دسته مخلوطها طبقهبندی نمیکنند، چون خواص آب نه به خواص هیدروژن شبیه است و نه به خواص اکسیژن. از ترکیب دو اتم هیدروژن و یک اتم اکسیژن، یک مولکول آب بوجود میآید. یک قطره آب دارای تعداد بی شماری مولکول آب میباشد.
معادله شیمیایی واکنش بین هیدروژن و اکسیژن و تشکیل آب از قرار زیر است:
هر مولکول آب دارای یک ناحیه مثبت و یک ناحیه منفی است که این دو ناحیه در دو طرف مولکول آب واقع شدهاند. شیمیدانها با کمک شواهد به این نتیجه رسیدهاند که مولکول آب شکل خطی ندارد، یعنی به این صورت نیست که دو اتم هیدروژن بصورت خطی در دو طرف یک اتم اکسیژن قرار گرفته باشند (HــOــH). بلکه مولکول آب حالت خمیده ای دارد که اتم های هیدروژن در سر مثبت مولکول و اتم های اکسیژن در سر منفی مولکول آب تجمع پیدا نموده اند.
اشکال متغیر
آب در اشکال متفاوتی بر روی زمین یافت میشود. تنها ماده ای است که در طبیعت به هر سه حالت جامد، مایع و گاز وجود دارد. ابرها در آسمان، موج دریا، کوه یخی، توده های یخی در دل کوه ها و منابع آبی زیرزمینی تنها چند شکل از آب میباشند. طی اعمال تبخیر، میعان، انجماد و ذوب، آب مرتباً از حالتی به حالت دیگر تبدیل میشود. این پدیده تبدیل آب را چرخه بزرگ آب مینامند.
از آنجا که بارندگی در صنعت کشاورزی و همچنین برای خود بشر بسیار با اهمیت است، به اشکال مختلف بارندگی نام های به خصوصی اطلاق میشود. بارندگی معمولاً بصورت باران است. دیگر اشکال آن، تگرگ،برف، مه و شبنم میباشند. همچنین، از برخورد نور با قطرات باران، رنگین کمان پدید میآید.
آبهای روی سطح زمین، نقش های مهمی ایفا میکنند؛ رودخانهها آب مورد نیاز کشاورزی را فراهم میکنند و دریاها هم وسیله ای برای تجارت و مبادله کالاها محسوب میشوند. توده های یخی و آبشارها هم از دیگر اشکال آب هستند. فرسایش به وسیله ی آب، نقش مهمی در شکل محیط زیست ایفا میکند.
به علاوه، دره ها و دلتاهای حاصل از رسوبات رودخانهها، محلی برای سکنی گزیدن انسان ها بوده است. آب به داخل زمین هم نفوذ میکند و آبهای زیرزمینی را ایجاد میکند. آبهای زیرزمینی را میتوان با کندن چاه یا قنات استخراج نمود. البته آب های زیرزمینی به شکل چشمه یا چشمه آب گرم هم به سطح زمین میآیند.
آب املاح و مواد معدنی مختلفی دارد که بر حسب آن مواد، طعم و مزه اش بسیار تفاوت میکند. البته ما انسانها ، خود ، قادریم که آشامیدنی بودن آبی را ارزیابی کنیم؛ مثلاً از آب شور دریا و یا آبهای بدبوی باتلاق ها استفاده نمیکنیم. بلکه آبی می نوشیم که سالم بوده و مناسب نیازهای بدنمان باشد.
اهمیت آب در زندگی
آب خواص مهمی دارد که در زندگی ما بسیار با ارزشند. از جمله:
حلال بسیار خوبی است.
چگالی بالایی دارد و جالب این که وقتی یخ میزند یا حرارت میبیند، چگالی آن کاهش مییابد.
گرمای تبخیر آب بالاست. یعنی برای تبدیل مقدار کمی آب به بخار، گرمای زیادی لازم است. این خاصیت برای بدن ما بسیار با اهمیت میباشد. گرمای اضافی بدن با تبخیر تنها مقدار کمی از آب بدن از طریق منافذ پوست تعریق کاسته میشود.
نیروی کشش سطحی آن به طور شگفت انگیزی زیاد است. گهگاه شاهد نشستنحشرات روی سطح آب بودهایم. اگر به دقت به طرز قرار گرفتن حشره روی سطح آب نگاه کنید، متوجه میشوید که سطح آب زیر پای حشره، مانند یک تشک ابری فرو میرود؛ اما پاره نمیشود.
آب مواد مختلف از جمله شکر و نمک را براحتی در خود حل میکند. بسیاری از واکنش های شیمیایی تنها در حضور آب انجام میشوند. البته پاره ای مواد با آب مخلوط نمیشوند، مثل لیپیدها و دیگر مواد هیدرات کربندار. غشاء سلولی که حاوی لیپیدها و پروتئین است، از این خاصیت آب سود جسته و تعاملات محتویات سلولی با مواد شیمیایی خارج سلول را بدقت تحت کنترل دارد.
یکی دیگر از خواص جالب آب، حالت جامد آن، یعنی یخ میباشد. هنگامی که آب بر اثر سرما به یخ تبدیل میشود، انبساط مییابد، بدین معنا که حجم بیشتری را اشغال میکند.
بنابراین، حجمی از یخ که همحجم آب اولیه است، جرم کمتری دارد. به این علت میگویند که چگالی یخ از آب کمتر است و همین مسئله باعث میشود که یخ روی آب شناور بماند. در حالی که در بیشتر موارد، چگالی ماده جامد از حالت مایع آن بیشتر است.
این ویژگی آب سبب میشود که بر خلاف بسیاری از مایعات، آب از سطح شروع به انجماد کند. این پدیده را بارها به هنگام شروع یخ زدن آب، درون فریزر منزلتان دیده اید؛ در زمستان با یخ زدن سطح آب دریاچهها، لایه عایقی از یخ ایجاد میشود که این لایه، از یخ زدن لایه های زیرین خود جلوگیری مینماید. در این شرایط ، ماهی هاو دیگر آبزیان میتوانند در مناطق گرمتر زیرین به حیات خود ادامه دهند.
دیگر ویژگی غیر عادی آب، ظرفیت گرمایی بالای آن میباشد. ظرفیت گرمایی یک جسم، مقدار گرمایی است که به جسم میدهیم تا دمایش، 1 درجه سانتی گراد افزایش یابد. جالب است بدانید که مقدار گرمایی که لازم است تا دمای 1 گرم آب را 1 درجه سانتی گراد افزایش دهد، حدود 10 برابر مقدار گرمایی است که برای 1 گرمآهن لازم است.
آب در زندگی روزانه
وجود هر گونه حیات، متکی به وجود آب است. آب در بیشتر فرایندهای متابولیسمی بدن، نقش حیاتی دارد. هنگام گوارش غذا، مقادیر قابل توجهی آب مورد استفاده قرار میگیرد.تقریباً 70 درصد وزن بدن را آب تشکیل میدهد. برای عملکرد درست، بدن ، روزانه به 1 تا 7 لیتر آب نیاز دارد البته این میزان آب به مقدار فعالیت بدن ، دمای هوا ، رطوبت و دیگر عوامل بستگی دارد. آب از طریق ادرار ، مدفوع ، تعریق و همچنین از طریق بازدم به شکل بخار آب دفع میشود.
بدن انسان به آبی نیاز دارد که نمک یا ناخالصی های دیگر ( مثل باکتری یا دیگر عوامل بیماریزا و یا مواد شیمیایی) نداشته باشد. البته برخی مواد محلول در آب طعم و مزه آن را بهتر هم میکند. امروزه ، با توجه به رشد روز افزون جمعیت ، میزان سرانه آب آشامیدنی کاهش یافته است.
راه حل های تحت بررسی، تولید بیشتر آب ، بهبود توزیع و جلوگیری از هدر رفتن آن میباشد.
مصرف آشکار و نهان آب
تحقیقات آماری در بسیاری از کشورها نشان میدهد که میانگین مصرف روزانه آب برای هر نفر ، حدود 300 لیتر است. در حالی که مصرف نهان آب برای هر نفر ، حدود 6000 لیتر و از قرار زیر میباشد:
آبیاری کشتزارها و تهیه و تولید مواد غذایی: 2600 لیتر
تأمین انرژی: 2400 لیتر
صنایع و معادن: 700 لیتر
امور بازرگانی و خدمات: 34 لیتر
منبع کمیاب
در بسیاری از کشورها ، آب نوعی منبع استراتژیک محسوب میشود. بسیاری از جنگها از جمله جنگ 6 روزه در خاور میانه، بر سر به دست آوردن منابع آبی بیشتر صورت گرفت. البته کارشناسان، مشکلات بیشتری را هم پیش بینی میکنند که بدلیل رشد جمعیت، آلودگی آب ها و گرم شدن زمین حادث میشود.
آب آشامیدنی
آبهای آشامیدنی را از چشمه ها ، قنات ها و یا چاه ها استخراج میکنند. بنابراین ، برای تولید بیشتر آب ، میتوان چاههای بیشتری ساخت. باران و دریا هم از دیگر منابع آبی هستند که البته به عنوان آب آشامیدنی مناسب نیستند. این گونه آبها را باید تصفیه نمود. روش های معروف تصفیه آب ، تقطیر و جوشاندن میباشند.
آب ، فرهنگ و مذهب
در بیشتر ادیان از جمله اسلام، مسیحیت و یهودیت، آب ماده پاککننده محسوب میشود. برای مثال، در مسیحیت غسل تعمید را در کلیسا با آب انجام میدهند.
در بسیاری ادیان همچون اسلام نوعی مراسم عبادی وجود دارد که در آن ، مرده را با آب پاک شستشو میدهند (غسل).


فرمول شیمیایی آب
آب نوعی ماده مرکب است که از دو عنصر اکسیژن و هیدروژن ساخته شده است. آب را جزو دسته مخلوطها طبقهبندی نمیکنند، چون خواص آب نه به خواص هیدروژن شبیه است و نه به خواص اکسیژن. از ترکیب دو اتم هیدروژن و یک اتم اکسیژن، یک مولکول آب بوجود میآید. یک قطره آب دارای تعداد بی شماری مولکول آب میباشد.معادله شیمیایی واکنش بین هیدروژن و اکسیژن و تشکیل آب از قرار زیر است:
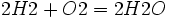
هر مولکول آب دارای یک ناحیه مثبت و یک ناحیه منفی است که این دو ناحیه در دو طرف مولکول آب واقع شدهاند. شیمیدانها با کمک شواهد به این نتیجه رسیدهاند که مولکول آب شکل خطی ندارد، یعنی به این صورت نیست که دو اتم هیدروژن بصورت خطی در دو طرف یک اتم اکسیژن قرار گرفته باشند (HــOــH). بلکه مولکول آب حالت خمیده ای دارد که اتم های هیدروژن در سر مثبت مولکول و اتم های اکسیژن در سر منفی مولکول آب تجمع پیدا نموده اند.
طبقه بندی قدرت نسبی اسیدها و بازها
بهترین راه برای مشاهده قدرت نسبی اسیدهای ضعیف از نظر کمی، به کارگیری جدول ثابت تفکیک اسیدی است، ولی شما غالباً با مشاهده فرمول آنها، می توانید به طور کیفی ضعیف یا قوی بودن اسید را طبقه بندی کنید.
اسیدهای قوی: دو نوع اسید قوی و مثال های مربوط به آنها عبارتند از:
1- هیدروهالیک اسیدها (اسیدهای بدون اکسیژن)، HI ، HBr ، HCl
2- اکسواسیدها (اسیدهای اکسیژن دار) که در آنها تعداد اتم اکسیژن دو یا بیشتر، بیش از تعداد پروتون های قابل یونش (هیدروژن های اسیدی) می باشد. (اختلاف تعداد اکسیژن و هیدروژن 2 و یا 3 است). این اسیدها مانند HNO3 ، H2SO4 و HClO4 می باشند، برای مثال در H2SO4 تعداد هیدروژن ها 2 و تعداد اکسیژن ها 4 است، یعنی تعداد اکسیژن دو تا بیشتر از تعداد هیدروژن 2 = 2 - 4
اسیدهای ضعیف: تعداد اسیدهای ضعیف بیشتر از اسیدهای قوی است. چهار نوع از این اسیدها با مثال مربوطه عبارتند از:
1- هیدروهالیک اسید HF
2- اسیدهایی که در ساختار آنها، H به O یا هالوژن متصل نیست مانند HCN و H2S
3- اکسو اسیدهایی که تعداد اتم های O مساوی و یا یکی بیشتر از تعداد هیدروژن های قابل یونش هستند، (اختلاف اکسیژن و هیدروژن صفر و یا یک است) مانند HClO ، HNO2 ، H3PO4
4- کربوکسیلیک اسیدها (فرمول کلی RCOOH که پروتون های قابل یونش در آنها به اکسیژن متصل است. مانند CH3COOH ، C6H5COOH
بازهای قوی: ترکیب های محلول در آب که یون های اکسید (O2- ) یا هیدروکسید (OH-) دارند. بازهای قوی هستند. کاتیون این بازها معمولاً از فلزهای فعال هستند.
1- M2O یا MOH که M فلز گروه 1 (IA) مانند Cs , Rb , K , Na , Li است.
2- MO یا M(OH)2 که M فلز گروه 2 (IIA) مانند Ba , Sr , Ca می باشد.
( MgO و Mg(OH)2 فقط کمی در آب حل می شوند و مقدار حل شده آن در آب به طور کامل تفکیک می شود.)
بازهای ضعیف: بسیاری از ترکیب ها با نیتروژن غنی از الکترون (دارای جفت الکترون آزاد) بازهای ضعیف هستند. (طبق تعریف آرنیوس باز محسوب نمی شوند) ساختار متداول اتم یک نیتروژن با زوج الکترون آزاد است.
1- آمونیاک ( NH3)
2- آمین ها (فرمول عمومی RNH2 ، R2NH یا R3N ) مانند CH3CH2NH2 ، (CH3)2NH و CH3)3N)
انتشار یافته در وبلاگ دهکده - آموزش شیمی
منبع: اصول شیمی عمومی سیلبربرگ، ترجمه دکتر مجید میرمحمد صادقی، دکتر غلامعباس پارسافر، دکتر محمدرضا سعیدی