وبلاگ تفریحی
دانلود آهنگ، دانلود فیلم، دانلود عکس، اس ام اسوبلاگ تفریحی
دانلود آهنگ، دانلود فیلم، دانلود عکس، اس ام استاریخچه شیمی
تاریخچه شیمی
واژه شیمی خود داستان درازی دارد. ریشه این نام در واژه کیمیاست. خاستگاه واژه کیمیا از زبان فارسی باستان است. این واژه و داستان دانش شگفت انگیز پشت آن به همراه دانشش به زبان عربی نوشته شد و اروپاییان با این واژه و دانش آن از راه مسلمانان آشنا شدند و این دانش را با نام alchemy شناختند. آنگاه آن را در میان خود پروردند تا در سدههای نزدیک به ریخت فرانسه شیمی به زبان ما بازگشت. دانش شیمی به دو گرایش شیمی محض و شیمی کاربردی تقسیم میشود.علم شیمی از ابتدا تا کنون به ۵ دوران تقسیم میشود ۱.دوران رشد کارهای تجربی ۲.دوران رشد جنبههای تئوری شیمی ۳.دوران کیمیا گری ۴.دوران اصل اتش ۵.دوران شیمی مدرن
شیمی یکی از علومی است که هموراه در زندگی بشر دخالت کامل داشته و وارد و به اندازه که تمدن کنونی بیشتر شود دخالت آن در شئون مختلف زندگی نیز زیادتر خواهد شد. ما در دنیایی زندگی می کنیم که پر از مواد شیمیایی گوناگون است. بعضی از این مواد مانند آب کاملاً برایمان آشنا است اما بسیاری مواد دیگر وجود دارند که چندان آشنا نیستند. واقعیت آن است که ما از هر لحاظ با مواد شیمیایی روبرو هستیم. لباسی که می پوشیم، غذایی که مصرف می کنیم، کاغذی که مطالب را روی آن می خوانیم همگی مواد شیمیایی به شمار می روند. علم شیمی از اجسام و خواص و ساختمان آنها و واکنشهایی که آنها را به اجسام دیگر تبدیل می نماید بحث می کند. طی هزاران سال، دانش شیمی تنها منحصر به تهیه اکسیرها، عطرها و جوهر های پاره ای از فلزات بود. یونانیان قرن پنجم که همواره در صدد پی بردن به رموز و اسرار طبیعت بودند آب را که مایه حیات سایر موجودات است عنصری ساده می پنداشتند حال آنکه آب ترکیبی از دو عنصر ساده اکسیژن و هیدروژن است.
فکر اولیه وجود عناصر ساده ابتدا از امپدوکل و سپس از ارسطو می باشد. ارسطو معتقد بود که چهار عنصر آب، هوا، خاک و آتش مظهر خواص اصلی از قبیل رنگ، استحکام و حالت اجسام می باشند و از ترکیب آنها مواد گوناگون به وجود می آید.
شیمی در طول تاریخ طولانی و تکاملی خود دورانهای گوناگونی را پشت سر گذاشته که می توان آن را به سه بخش عمده تقسیم کرد: دوران باستان که هنوز شیمی به صورت یک علم مشخص درنیامده بود. دوران کیمیاگری از آستانه پیدایش مسیحیت تا سالهای 1700 میلادی و دوران شیمی جدید.
در سراسر دوران تاریک قرون وسطی دانش شیمی نیز همچون دیگر رشته های علوم پیشرفت قابل ملاحظه ای ننمود. کشف الکل و جوهر گوگرد به وسیله کیمیاگر ایرانی محمد زکریای رازی و کشف فسفر در سال 1675 میلادی توسط براند آلمانی از آثار دوره کیمیاگری است. کیمیاگری تنها در اواخر قرن هفدهم و اوایل قرن هجدهم بود که به صورت دانشی حقیقی و واقعی به نام شیمی در آمد. رابرت بویل انگلیسی نخستین کسی بود که دلیرانه با نظرات و عقاید قدما درباره وجود عناصر چهارگانه و تبدیل فلزات مخالفت نمود. به عقیده بویل عنصر جسمی است غیرقابل تجزیه و از ترکیب آنها اجسام مختلف پدید می آید. نظریات بویل در کتاب شیمیدانان شکاک کم و بیش یادآور نگرش ابن سینا در کتاب «ابطال کیمیا» است که در شش قرن پیش از آن به رشته تحریر درآورد. ژوزف بلاک شیمیست اسکاتلندی در سال 1757 گاز کربنیک را به دست آورد و آن را هوای ثابت نامید. ژوزف پریستلی انگلیسی در سال 1774 گاز اکسیژن را ضمن حرارت دادن اکسید قرمز جیوه برای نخستین بار تهیه کرد. هنری کاواندیش دانشمند انگلیسی نیز در سال 1766 هیدروژن خالص را کشف نمود و خواص آن را معلوم و مشخص نمود. برگمان شیمیست سوئدی این نظر را ارائه کرد که هوا مخلوطی از سه گاز است. هوای معیوب (ازت)، هوای خالص (اکسیژن) و اسید هوایی (گاز کربنیک) بالاخره شارک گیوم سئل شیمیست دیگر سوئدی درباره بی اکسید منگنز مطالعاتی کرد و همین موضوع راهنمای او برای تهیه اکسیژن گردید. لاووازیه که در حقیقت بنیانگذار شیمی جدید محسوب می شود گامهای بلندی در راه آزمایش و پژوهش علمی برداشت. کشف گازهای اکسیژن و هیدروژن به لاووازیه این امکان را داد که به تفسیر علمی درستی برای پدیده سوخت و ارتباط آن با هوا نائل آید. لاووازیه ثابت نمود که عمل سوختن ترکیب جسم است با اکسیژن و در این مورد یکی از قوانین اصلی شیمی یعنی اصل بقاء ماده را به شرح زیر وضع کرد:
هیچ چیز از بین نمی رود و هیچ چیز خلق نمی شود. در تمام واکنشهای شیمیایی مجموع وزنهای مواد پیش از فعل و انفعال شیمیایی مساوی وزنهای مواد به دست آمده است.
در آغاز قرن هجدهم یعنی در سال 1800 میلادی ولتا فیزیکدان انگلیسی نخستین پیل را کشف کرد و از آن پس الکتروشیمی در دسترس جهانیان قرار گرفت. دیوی انگلیسی از تجزیه الکتریکی پتاس مذاب فلز پتاسیم و سپس از سود گداخته فلز سدیم را به دست آورد. او با تجزیه الکتریکی ثابت کرد که برخلاف عقیده لاووازیه که اکسیژن را عامل ترشی می نامید تمام اسیدها اکسیژن ندارند. همچنین وهلر آلمانی در آغاز این قرن با استفاده از پتاسیم موفق به کشف آلومینیوم گردید و از آن پس عناصر یکی پس از دیگری پیدا شدند. در اواخر نوزدهم دیمتری مندلیف شیمیست نابغه روس با تنظیم جدول تناوبی معروف خود عده زیادی از عناصر را از خاصیت تکرار اتمها پیش بینی کرد و با کشف آنها شیمی در ردیف علوم مدرن و درجه اول قرار گرفت. بالاخره در حدود سال 1760 برتلو شیمیست بزرگ فرانسوی توانست از ترکیب مستقیم کربن و هیدروژن استیلن را تهیه نماید. شیمی جدید به عنوان یک علم نظام یافت طی 200 سال گذشته شکل گرفت و از همان آغاز به کلی از شیوه های کیمیاگری دور شد. از آغازقرن نوزدهم تا کشف و نوآوری در علم شیمی و کاربردهای آن در تکنولوژی و زندگی با سرعت هرچه تمامتر ادامه دارد.
نگاه گذرا
تئوری اتمی پایه و اساس علم شیمی است. این تئوری بیان میدارد که تمام مواد از واحدهای بسیار کوچکی به نام اتم تشکیل شدهاند. یکی از اصول و قوانینی که در مطرح شدن شیمی به عنوان یک علم تأثیر بهسزایی داشته، اصل بقای جرم است. این قانون بیان میکند که در طول انجام یک واکنش شیمیایی معمولی، مقدار ماده تغییر نمیکند. (امروزه فیزیک مدرن ثابت کرده که در واقع این انرژی است که بدون تغییر میماند و همچنین انرژی و جرم با یکدیگر رابطه دارند.)
این مطلب به طور ساده به این معنی است که اگر دههزار اتم داشته باشیم و مقدار زیادی واکنش شیمیایی انجام پذیرد، در پایان ما همچنان بطور دقیق دههزار اتم خواهیم داشت. اگر انرژی از دست رفته یا بهدستآمده را مد نظر قرار دهیم، مقدار جرم نیز تغییر نمیکند. شیمی کنش و واکنش میان اتمها را به تنهایی یا در بیشتر موارد بههمراه دیگر اتمها و بهصورت یون یا مولکول (ترکیب) بررسی میکند.
این اتمها اغلب با اتمهای دیگر واکنشهایی را انجام میدهند. (برای نمونه زمانیکه آتش چوب را میسوزاند واکنشی است بین اتمهای اکسیژن موجود در هوا که نور بر روی مواد شیمیایی فیلم عکاسی ایجاد میکند شکل میگیرد.)
یکی از یافتههای بنیادین و جالب دانش شیمی این بودهاست که اتمها رویهمرفته همیشه به نسبت برابر با یکدیگر ترکیب میشوند. سیلیس دارای ساختمانی است که نسبت اتمهای سیلیسیوم به اکسیژن در آن یک به دو است. امروزه ثابت شدهاست که استثناهایی در زمینهٔ قانون نسبتهای معین وجود دارد(مواد غیر استوکیومتری).
یکی دیگر از یافتههای کلیدی شیمی این بود که زمانی که یک واکنش شیمیایی مشخص رخ میدهد، مقدار انرژی که بدست میآید یا از دست میرود همواره یکسان است. این امر ما را به مفاهیم مهمی مانند تعادل ، ترمودینامیک میرساند.
شیمی فیزیک بر پایهٔ فیزیک پیشرفته (مدرن) بنا شدهاست. اصولاً میتوان تمام سیستمهای شیمیایی را با استفاده از تئوری مکانیک کوانتوم شرح داد. این تئوری از لحاظ ریاضی پیچیده بوده و عمیقاً شهودی است. به هر حال در عمل و بطور واقعی تنها بررسی سیستمهای سادهٔ شیمیایی قابل بررسی با مفاهیم مکانیکی کوانتوم امکانپذیر است و در اکثر مواقع باید از تقریب استفاده کرد(مانند تئوری کاری دانسیته). بنابراین درک کامل مکانیک کوانتوم برای تمامی مباحث شیمی کاربرد ندارد؛ زیرا نتایج مهم این تئوری (بخصوص اربیتال اتمی) با استفاده از مفاهیم سادهتری قابل درک و بهکارگیری هستند.
با اینکه در بسیاری موارد ممکن است مکانیک کوانتوم نادیده گرفته شود، مفهوم اساسی که پشت آن است، یعنی کوانتومی کردن انرژی، چنین نیست. شیمیدانها برای بکارگیری کلیه روشهای طیف نمایی به آثار و نتایج کوانتوم وابستهاند، هرچند که ممکن است بسیاری از آنها از این امر آگاه نباشند. علم فیزیک هم ممکن است مورد بی توجهی واقع شود، اما به هر حال برآیند نهایی آن (مانند رزونانس مغناطیسی هستهای) پژوهیده و مطالعه میشود.
یکی دیگر از تئوریهای اصلی فیزیک مدرن که نباید نادیده گرفته شود نظریه نسبیت است. این نظریه که از دیدگاه ریاضی پیچیدهاست، شرح کامل فیزیکی علم شیمی است. مفاهیم نسبیتی تنها در برخی از محاسبات خیلی دقیق ساختمان هسته، بهویژه در عناصر سنگینتر، کاربرد دارند و در عمل تقریباً با شیمی پیوند ندارند.
بخشهای اصلی دانش شیمی عبارتاند از:
شیمی تجزیه، که به تعیین ترکیبات مواد و اجزای تشکیل دهنده آنها میپردازد.
شیمی آلی، که به مطالعهٔ ترکیبات کربندار، غیر از ترکیباتی چون دو اکسید کربن (دی اکسید کربن) میپردازد.
شیمی معدنی، که به اکثریت عناصری که در شیمی آلی روی آنها تاکید نشده و برخی خواص مولکولها میپردازد.
شیمی فیزیک، که پایه و اساس کلیهٔ شاخههای دیگر را تشکیل میدهد، و شامل ویژگیهای فیزیکی مواد و ابزار تئوری بررسی آنهاست.
دیگر رشتههای مطالعاتی و شاخههای تخصصی که با شیمی پیوند دارند عبارتاند از: علم مواد، مهندسی شیمی، شیمی بسپار، شیمی محیط زیست و داروسازی.
شاخههای شیمی
شیمی آلی - شیمی معدنی - شیمی تجریه- شیمی فیزیک - شیمی گاز - نانو طراحی فرآیندهای صنایع نفت - فیتو شیمی - شیمی کاربردی - شیمی پالایش - زیستشیمی (بیوشیمی) - شیمی محض - شیمی دریا - شیمی آموزش
کلمهٔ کیمیا از کلمها ی فارسی بوده و به معنای طلا میباشد.و به خاطر قدمت این علم در ایران ان را علم بومی ایران دانستهاند.
عنصر شیمیایی
عنصر شیمیایی، در دانش شیمی، به مادهای گفته میشود که اتمهای آن تعداد پروتونهای برابر در هستهی خود داشته باشند. گاهی نیز برای سادگی، به عنصر شیمیایی صرفاً عنصر گفته میشود. به تعداد پروتونهای درون هستهٔ یک اتم، عدد اتمی گفته میشود. به عنوان مثال، تمام اتمهایی که ۶ عدد پروتون در هستهٔ خود داشته باشند، عنصر شیمیایی کربن هستند. همچنین تمام اتمهایی که تعداد پروتونهای درون هستهٔ آنها ۹۲ عدد باشد، عنصر اورانیوم به شمار میروند. هم اکنون تعداد عناصر شیمیایی در جدول تناوبی حدود ۱۱۵ عنصر برآورد میشود.
مولکول
مولکول، کوچکترین ذره یک ماده شیمیایی خالص است که ویژگیهای آن ماده را دارد. یک مولکول از دو یا چند اتم تشکیل شده که با پیوند شیمیایی به هم متصلند. البته مولکول بعضی عناصر (همچون گازهای بیاثر) تنها از یک اتم تشکیل شده است.
اتمهای تشکیل دهنده یک مولکول، ممکن است از یک عنصر (به طور مثال در اکسیژن) یا چند عنصر (مثلاً در آب) تشکیل شده باشند.
نسبت اتمها در یک مولکول خاص همیشه ثابت است. برای مثال در مولکول آب نسبت اتمهای هیدروژن به اکسیژن همیشه 2 است. تعداد اتمهای موجود در یک مولکول به وسیله فرمول شیمیایی آن نشان داده میشود. البته باید توجه داشت که تنها فرمول شیمیایی نشان دهنده ویژگیهای ماده نیست. ممکن است دو ماده فرمول شیمیایی یکسانی داشته باشند، اما ویژگیهای آنها کاملاً متفاوت باشد. برای مثال اتانول و دیمتیل اتر فرمول شیمیایی یکسان، اما خواص شیمیایی متفاوت دارند. به این مواد ایزومر گفته میشود.
مولکول
یک مولکول ، مجموعه ای از اتم های یک ماده ی مشخص دارای فرمول شیمیایی است. کلمه مولکول از زبان لاتین گرفته شده وبه معنی یک توده ی کوچکی از مواد می باشد برای مثال مولکول متان(CH4) از یک اتم کربن و چهار اتم هیدروژن تشکیل شده است.
یک مولکول ذره ای از موادی است که دارای قابلیت حرکت و مستعد دادن واکنش شیمیایی با مواد دیگرهستند در حالی که اتم از ذرات کوچک ثابت تری تشکیل شده و جابجای انها نیازمند انرژی بسیار زیادی است که برای انجام واکنش های هسته ای ضروری است
خاصیت مولکولها
مولکول های یک ماده در حال جنبش و حرکت دایمی هستند این جنبش مولکول ها حرکت براون نام دارد که برای اولین بار توسط روبرت براون در سال 1821میلادی کشف شده است. وقتی ماده به شکل گاز است مولکول ها دارای جنبش بسیار زیاد هستند و فضای ما بین مولکولها زیاد است در حالت مایع فضای بین مولکولی کمتر و جنبش مولکول ها نیز کمتر است در حالت جامد مولکولها به صورت منظمی چیده شدند و دارای چرخش به دور یک فضای مشخص هستند دمای یک ماده نشانگر میزان جنبش مولکول های آن ماده است
نیروی واندروالس یک نیروی ضعیفی است که بیانگرفاصله ی بین مولکول هاست .
ماکرومولکول ها
مولکولهای که دارای اندازه ی خیلی بزرگ هستند و حداقل از چندین هزار اتم تشکیل شدند : مثل پروتئینها , اسید های نوکلئیک و کربوهیدراتها
ترکیبات غیر مولکولی
شامل دو دسته ی بزرگ هستند ; فلزات و ترکیبات یونی
فلزات که از دسته ای از اتم های مرتبط با هم تشکیل شده و دارای پیوند فلزی میباشد
ترکیبات یونی مجموعه ای از اتم های دارای پیوند های یونی می باشند.
شیمی و آلودگی محیط زیست
شیمی در محیط زیست ما نقش اساسی دارد. در واقع در بین مردم متداول است که بیشتر مسائل آلودگی جاری را به گردن مواد شیمیایی سنتزی و پدید آورندگان آنها بیاندازند. اما این نکته ناگفته میماند که بیشتر مسائل زیست محیطی ، قرنها و دهههای گذشته ، مانند آلودگی میکروبی آب آشامیدنی ، تنها زمانی برطرف شدند که روشهای علمی بطور کلی و شیمی بطور اخص در مورد آنها بکار گرفته شد. افزایش شگفت انگیز عمر انسان و بهبود کیفیت زندگی در دهههای اخیر به مقدار زیاد به علت پیشرفت شیمی و پدید آمدن مواد شیمیایی جدید بوده است.
محصولات فرعی اجسامی که برای بهتر شدن سلامتی و بالا رفتن استاندارد زندگی ما بکار گرفته شدهاند، در مواردی بوسیله تنزل دادن سلامتی ما و همچنین سلامتی گیاهان و حیوانات ، همچون شبهی ما را دنبال میکنند. بطور خلاصه ، غلبه ما بر آلودگی گسترده زیست شناختی و بالا بردن استانداردهای سلامتی و ثروت مادی در کشورهای توسعه یافته به قیمت آلودگی شیمیایی گسترده کره زمین در سطح کم تمام شده است.
مواد شیمیایی و نظرات دانشمندان
تا به حال در بین دانشمندان در این باره که آیا آلودگی بوسیله مواد شیمیایی در سطح کم بر روی سلامتی انسانها یا سایر موجودات زنده اثر مضر و نامطلوب دارد، اتفاق نظر نیست. بعضی از دانشمندان ، خطر هر گونه اثرهای زیان آوری را به علت تاثیر مواد شیمیایی سنتزی (بویژه موادی که در ایجاد سرطان دخالت دارند) بطور کامل رد میکنند. این مواد به غلظتهای خیلی بیشتر اجسام سمی طبیعی مانند آفت کشهایی که بوسیله گیاهان تولید میشود و ما در معرض آنها قرار داریم، اشاره میکنند. در انتهای دیگر این طیف ، دانشمندانی هستند که معتقدند مواد شیمیایی در محیط زیست نقش عمدهای در شروع انواع معینی از سرطانها و نواقص در انسانها و حیات وحش دارند
راههای جلوگیری از آلودگی
این نکته روشن است که احتمالا سلامتی و رفاه انسانها از راههای ظریف اما موثری بوسیله غلظتهای کم از مواد شیمیایی در محیط زیست ما تحت تاثیر قرار میگیرد. از نظر تاریخی بطور ضمنی یا به طور صریح اینطور فرض شده بود که مواد شیمیایی منتشر شده در محیط زیست بوسیله طبیعت تحلیل خواهند رفت. اما امروزه میدانیم که چنین نیست. بسیاری از مواد پلیمری که امروزه در جامعه و صنعت تولید میشوند قرنها قابل تجزیه و بازگشت به چرخه طبیعی نیستند.
راهبرد اولیه این بود اغلب بوسیله جمع آوری و دور ریختن تودههای زیادی از این مواد ، پیش از اینکه در محیط زیست پخش شوند، از رها شدن آنها جلوگیری شود. پس از جمع آوری ، آنها را به صورت اجسام جامد درمیآورند و در زمینهای بایر میریزند. یک اشکال این قبیل راهبردها این است که آلایندهها معمولا در این فرآیند منهدم نمیشوند بلکه صرفا به صورت مطلوبتری درمیآیند یا اینکه در محیط متفاوتی رسوب داده میشوند. راهبرد شیمی سبز که اکنون جای راه حل بالا را میگیرد، تجدید نظر در فرمول بندی راههایی است که در سنتز مواد شیمیایی در درجه اول محصولات فرعی سمی تولید نشوند.
قلمروهای شیمی زیست
موضوع شیمی محیط زیست هم شامل اجسام و فرآیندهای طبیعی است که در یک محیط زیست پاکیزه حائز اهمیتند و هم اینکه مسائل آلودگی قابل ملاحظهای را که مبنای شیمیایی دارند، دربرمیگیرد. اگر چه طبیعت اکثرا موضوعهای مورد بحث به گونهای است که بیش از یک محیط فیزیکی یا یک ترکیب را دربرمیگیرند، اما مطالب مورد بحث شیمی محیط زیست به اینگونه طبقه بندی کلی میشوند:
شیمی اتمسفر
مواد شیمیایی آلی سمی - شیمی آب ، از جمله فلزات سنگین و نقش خاکها و رسوبها
منابع سوخت و انرژی ، از جمله انرژی هستهای - مسائل محیط زیستی بطور کلی ناشی از افزایش جمعیت دنیاست افزون بر این بسیاری از مسائل زیست محیطی وجود دارند که مورد بحث شیمی محیط زیست نیستند، زیرا این مسائل عمدتا منشا شیمیایی ندارند.
آب سنگین چیست؟
S آب سنگین چیست؟
آب سنگین از جدا سازی نوعی از مولکول های آب با غلظت 1 در هر 7000 مولکول به دست می آید که هیدروژن آن یک نوترون بیشتر از هیدروژن عادی دارد.یعنی بجای دواتم هیدروژن درمولکول آب معمولی (H2O )، دواتم هیدروژن سنگین (دوتریم) وجود دارد(D2O).
آب سنگین یکی از مواد اصلی در راه اندازی راکتورهای تولید انرژی و تحقیقاتی موسوم به راکتورهای آب سنگین به شمار می رود. این ماده وظیفه خنک کردن میله های سوخت , همزمان با کند کردن نوترون های پر انرژی را به عهده دارد. نوترون اضافه دراین نوع آب موجب می شود تا عمل کند کنندگی نوترون های پر سرعت به اندازه ای برسد که واکنش های زنجیره ای تولید انرژی از میله های سوخت آغاز شود.
لازم به ذکر است که راکتورهای آب سنگین نیازی به اورانیوم غنی شده ندارند و از اکسید اورانیوم طبیعی به عنوان سوخت استفاده می کنند.
آب چیست؟
آب ماده ای فراوان در کره زمین است. به شکل های مختلفی همچون دریا ، باران ،رودخانه و... دیده میشود. آب در چرخه خود ، مرتباً از حالتی به حالت دیگر تبدیل میشود، اما از بین نمیرود. هر گونه حیات محتاج آب میباشد. انسان ها از آبآشامیدنی استفاده میکنند، یعنی آبی که کیفیت آن مناسب سوخت و ساز بدن باشد.
با رشد جمعیت، منابع آب طبیعی در حال تمام شدن هستند و این مسئله ، سبب نگرانی بسیاری از دولتها در سراسر دنیا شده است. گاهی بدلیل مشکلات کمبود آب ، این ماده را جیره بندی میکنند تا مصرف آن را تعدیل نمایند.
فرمول شیمیایی آب
آب نوعی ماده مرکب است که از دو عنصر اکسیژن و هیدروژن ساخته شده است. آب را جزو دسته مخلوطها طبقهبندی نمیکنند، چون خواص آب نه به خواص هیدروژن شبیه است و نه به خواص اکسیژن. از ترکیب دو اتم هیدروژن و یک اتم اکسیژن، یک مولکول آب بوجود میآید. یک قطره آب دارای تعداد بی شماری مولکول آب میباشد.
معادله شیمیایی واکنش بین هیدروژن و اکسیژن و تشکیل آب از قرار زیر است:
هر مولکول آب دارای یک ناحیه مثبت و یک ناحیه منفی است که این دو ناحیه در دو طرف مولکول آب واقع شدهاند. شیمیدانها با کمک شواهد به این نتیجه رسیدهاند که مولکول آب شکل خطی ندارد، یعنی به این صورت نیست که دو اتم هیدروژن بصورت خطی در دو طرف یک اتم اکسیژن قرار گرفته باشند (HــOــH). بلکه مولکول آب حالت خمیده ای دارد که اتم های هیدروژن در سر مثبت مولکول و اتم های اکسیژن در سر منفی مولکول آب تجمع پیدا نموده اند.
اشکال متغیر
آب در اشکال متفاوتی بر روی زمین یافت میشود. تنها ماده ای است که در طبیعت به هر سه حالت جامد، مایع و گاز وجود دارد. ابرها در آسمان، موج دریا، کوه یخی، توده های یخی در دل کوه ها و منابع آبی زیرزمینی تنها چند شکل از آب میباشند. طی اعمال تبخیر، میعان، انجماد و ذوب، آب مرتباً از حالتی به حالت دیگر تبدیل میشود. این پدیده تبدیل آب را چرخه بزرگ آب مینامند.
از آنجا که بارندگی در صنعت کشاورزی و همچنین برای خود بشر بسیار با اهمیت است، به اشکال مختلف بارندگی نام های به خصوصی اطلاق میشود. بارندگی معمولاً بصورت باران است. دیگر اشکال آن، تگرگ،برف، مه و شبنم میباشند. همچنین، از برخورد نور با قطرات باران، رنگین کمان پدید میآید.
آبهای روی سطح زمین، نقش های مهمی ایفا میکنند؛ رودخانهها آب مورد نیاز کشاورزی را فراهم میکنند و دریاها هم وسیله ای برای تجارت و مبادله کالاها محسوب میشوند. توده های یخی و آبشارها هم از دیگر اشکال آب هستند. فرسایش به وسیله ی آب، نقش مهمی در شکل محیط زیست ایفا میکند.
به علاوه، دره ها و دلتاهای حاصل از رسوبات رودخانهها، محلی برای سکنی گزیدن انسان ها بوده است. آب به داخل زمین هم نفوذ میکند و آبهای زیرزمینی را ایجاد میکند. آبهای زیرزمینی را میتوان با کندن چاه یا قنات استخراج نمود. البته آب های زیرزمینی به شکل چشمه یا چشمه آب گرم هم به سطح زمین میآیند.
آب املاح و مواد معدنی مختلفی دارد که بر حسب آن مواد، طعم و مزه اش بسیار تفاوت میکند. البته ما انسانها ، خود ، قادریم که آشامیدنی بودن آبی را ارزیابی کنیم؛ مثلاً از آب شور دریا و یا آبهای بدبوی باتلاق ها استفاده نمیکنیم. بلکه آبی می نوشیم که سالم بوده و مناسب نیازهای بدنمان باشد.
اهمیت آب در زندگی
آب خواص مهمی دارد که در زندگی ما بسیار با ارزشند. از جمله:
حلال بسیار خوبی است.
چگالی بالایی دارد و جالب این که وقتی یخ میزند یا حرارت میبیند، چگالی آن کاهش مییابد.
گرمای تبخیر آب بالاست. یعنی برای تبدیل مقدار کمی آب به بخار، گرمای زیادی لازم است. این خاصیت برای بدن ما بسیار با اهمیت میباشد. گرمای اضافی بدن با تبخیر تنها مقدار کمی از آب بدن از طریق منافذ پوست تعریق کاسته میشود.
نیروی کشش سطحی آن به طور شگفت انگیزی زیاد است. گهگاه شاهد نشستنحشرات روی سطح آب بودهایم. اگر به دقت به طرز قرار گرفتن حشره روی سطح آب نگاه کنید، متوجه میشوید که سطح آب زیر پای حشره، مانند یک تشک ابری فرو میرود؛ اما پاره نمیشود.
آب مواد مختلف از جمله شکر و نمک را براحتی در خود حل میکند. بسیاری از واکنش های شیمیایی تنها در حضور آب انجام میشوند. البته پاره ای مواد با آب مخلوط نمیشوند، مثل لیپیدها و دیگر مواد هیدرات کربندار. غشاء سلولی که حاوی لیپیدها و پروتئین است، از این خاصیت آب سود جسته و تعاملات محتویات سلولی با مواد شیمیایی خارج سلول را بدقت تحت کنترل دارد.
یکی دیگر از خواص جالب آب، حالت جامد آن، یعنی یخ میباشد. هنگامی که آب بر اثر سرما به یخ تبدیل میشود، انبساط مییابد، بدین معنا که حجم بیشتری را اشغال میکند.
بنابراین، حجمی از یخ که همحجم آب اولیه است، جرم کمتری دارد. به این علت میگویند که چگالی یخ از آب کمتر است و همین مسئله باعث میشود که یخ روی آب شناور بماند. در حالی که در بیشتر موارد، چگالی ماده جامد از حالت مایع آن بیشتر است.
این ویژگی آب سبب میشود که بر خلاف بسیاری از مایعات، آب از سطح شروع به انجماد کند. این پدیده را بارها به هنگام شروع یخ زدن آب، درون فریزر منزلتان دیده اید؛ در زمستان با یخ زدن سطح آب دریاچهها، لایه عایقی از یخ ایجاد میشود که این لایه، از یخ زدن لایه های زیرین خود جلوگیری مینماید. در این شرایط ، ماهی هاو دیگر آبزیان میتوانند در مناطق گرمتر زیرین به حیات خود ادامه دهند.
دیگر ویژگی غیر عادی آب، ظرفیت گرمایی بالای آن میباشد. ظرفیت گرمایی یک جسم، مقدار گرمایی است که به جسم میدهیم تا دمایش، 1 درجه سانتی گراد افزایش یابد. جالب است بدانید که مقدار گرمایی که لازم است تا دمای 1 گرم آب را 1 درجه سانتی گراد افزایش دهد، حدود 10 برابر مقدار گرمایی است که برای 1 گرمآهن لازم است.
آب در زندگی روزانه
وجود هر گونه حیات، متکی به وجود آب است. آب در بیشتر فرایندهای متابولیسمی بدن، نقش حیاتی دارد. هنگام گوارش غذا، مقادیر قابل توجهی آب مورد استفاده قرار میگیرد.تقریباً 70 درصد وزن بدن را آب تشکیل میدهد. برای عملکرد درست، بدن ، روزانه به 1 تا 7 لیتر آب نیاز دارد البته این میزان آب به مقدار فعالیت بدن ، دمای هوا ، رطوبت و دیگر عوامل بستگی دارد. آب از طریق ادرار ، مدفوع ، تعریق و همچنین از طریق بازدم به شکل بخار آب دفع میشود.
بدن انسان به آبی نیاز دارد که نمک یا ناخالصی های دیگر ( مثل باکتری یا دیگر عوامل بیماریزا و یا مواد شیمیایی) نداشته باشد. البته برخی مواد محلول در آب طعم و مزه آن را بهتر هم میکند. امروزه ، با توجه به رشد روز افزون جمعیت ، میزان سرانه آب آشامیدنی کاهش یافته است.
راه حل های تحت بررسی، تولید بیشتر آب ، بهبود توزیع و جلوگیری از هدر رفتن آن میباشد.
مصرف آشکار و نهان آب
تحقیقات آماری در بسیاری از کشورها نشان میدهد که میانگین مصرف روزانه آب برای هر نفر ، حدود 300 لیتر است. در حالی که مصرف نهان آب برای هر نفر ، حدود 6000 لیتر و از قرار زیر میباشد:
آبیاری کشتزارها و تهیه و تولید مواد غذایی: 2600 لیتر
تأمین انرژی: 2400 لیتر
صنایع و معادن: 700 لیتر
امور بازرگانی و خدمات: 34 لیتر
منبع کمیاب
در بسیاری از کشورها ، آب نوعی منبع استراتژیک محسوب میشود. بسیاری از جنگها از جمله جنگ 6 روزه در خاور میانه، بر سر به دست آوردن منابع آبی بیشتر صورت گرفت. البته کارشناسان، مشکلات بیشتری را هم پیش بینی میکنند که بدلیل رشد جمعیت، آلودگی آب ها و گرم شدن زمین حادث میشود.
آب آشامیدنی
آبهای آشامیدنی را از چشمه ها ، قنات ها و یا چاه ها استخراج میکنند. بنابراین ، برای تولید بیشتر آب ، میتوان چاههای بیشتری ساخت. باران و دریا هم از دیگر منابع آبی هستند که البته به عنوان آب آشامیدنی مناسب نیستند. این گونه آبها را باید تصفیه نمود. روش های معروف تصفیه آب ، تقطیر و جوشاندن میباشند.
آب ، فرهنگ و مذهب
در بیشتر ادیان از جمله اسلام، مسیحیت و یهودیت، آب ماده پاککننده محسوب میشود. برای مثال، در مسیحیت غسل تعمید را در کلیسا با آب انجام میدهند.
در بسیاری ادیان همچون اسلام نوعی مراسم عبادی وجود دارد که در آن ، مرده را با آب پاک شستشو میدهند (غسل).


سنتز نانو مواد
تهیه نانومواد با روش سل – ژل (1)

روشهای زیادی، از جمله فرآیند سل- ژل (روش محلولی)، تراکم بخار خنثی، آلیاژسازی مکانیکی یا برخورد باگلوله های پر انرژی، روش پلاسما و روش های الکتروشیمیایی از روشهای معمول برای تولید نانو ذرات هستند. اگر چه همه روشهای ذکر شده برای تولید حجم زیادی از نانو مواد استفاده می شوند، اما روش سل- ژل دارای محبوبیت و کاربرد صنعتی بالاتری نسبت به سایر روش های موجود است و این امر بی علت نیست! سل – ژل هم اکنون می تواند نانو ذراتی با کیفیت بالا ( تولید ذرات با اندازه یکسان) را در حجمی بالا تولید کند. این روش قادر است همزمان دو یا چند نوع نانو ذره را با هم تولید کند. مفهوم این جمله این است که با مخلوط کردن پیش ماده های سنتز دو یا چند فلز ( یا اکسید فلز ) مختلف با نسبت های معین قادر خواهیم بود که محصولات آلیاژی را در یک مرحله سنتز کنیم. البته روش های دیگری هم هستند که قادر به انجام چنین کاری می باشند (روش پلاسما و روش های الکتروشیمیایی و چگالش از فاز) ولی باید خاطر نشان کرد که در مقیاس صنعتی هیچ کدام از آنها قادر به رقابت با روش سل - ژل نیستند.
روش سل- ژل همچنین می تواند امکان ساخت کامپوزیتهای بسیار همگن و با خلوص بسیار بالا ( با 99.99 درصد خلوص ) را فراهم کند. همچنین این روش قادر است نسبت به روشهای رایج که محدوده دمایی بسیار بالایی ( بین 1400 تا 3600 درجه سانتیگراد ) دارند، نانو مواد سرامیکی و فلزی را در دماهای بسیار پایین تری ( حدود 70 تا 320 درجه سانتیگراد ) تولید کند.
از دیگر دلایل محبوبیت روش سل – ژل به اختصار میتوان موارد زیر را ذکر کرد:
1) سنتز در دمای پائین
2) ابزار انجام آن ساده است
3) تهیه محصولاتی با خلوص بالا
4) راندمان تولید بسیار بالا
5) تولید قطعات اپتیکی با اشکال پیچیده
6) سنتز ترکیبات یکنواخت به صورت اکسیدهای کامپوزیتی
7) امکان طراحی ترکیب شیمیایی و بهدست آوردن ترکیب همگن وجود دارد
8) امکان استفاده از محصول به اشکال خاص مثل الیاف ، آئروژل و تهیه پوشش سطوح
9) امکان استفاده از این فرایند برای سنتز مواد در حالت بی¬شکل و به کارگیری آنها جهت لایههای نازک
10) تولید مواد دارای خواص فیزیکی اصلاح شده مانند ضریب انبساط حرارتی پایین و جذب اشعه Uv کم و شفافیت اپتیکی بالا
11) تولید مواد متخلخل که اجازه غنی شدن با ترکیبات آلی و پلیمری را می دهد
12) واکنش پذیری شیمیایی بالای پیش ماده ها به دلیل انجام فرایند در فاز محلول
13) کنترل دقیق ساختار مواد با امکان تنظیم متغیرهای مرحله اولیه تشکیل سل و تشکیل شبکه
14) سرمایهگذاری اولیه کم و در عین حال کیفیت بالای محصولات
فرآیند سل- ژل روش جدیدی نیست. در سال 1800 «ابلمن» به طور اتفاقی مشاهده کرد که تتراکلرید سیلیکون (SiCl4) که در ظرفی رها شده بود، ابتدا هیدرولیز و سپس به ژل تبدیل شد. در سال 1950 مطالعات گستردهای در زمینه سنتز سرامیکﻫﺎ و ساختارهای شیشهای با استفاده از این روش آغاز شد. شایان ذکر است که با این روش، بسیاری از اکسیدهای غیرآلی مانند TiO2، SiO2، ZrO2 سنتز شدند. آئروژل ها یکی از محصولات فرایند سل- ژل هستند. ساده ترین تعریف از یک آئروژل، ژلی خشک است که با حذف رطوبت از یک ژل مرطوب به دست آمده است. بسته به شیوه حذف رطوبت، ساختمان این ژل تا حد زیادی ساختار ژل خیس (ژل اولیه) را حفظ می کند. ژل خیس را می توان با فرایندهای مختلفی آماده کرد. به این روشها عموماً روشهای سل- ژل اطلاق می شود. در زیر واکنش های شیمیایی درگیر در روش سل ژل به اختصار آورده شده است:


2 مراحل فرآیند سل ژل
برای تولید محصول به روش سل – ژل لازم است ابتدا مقدمات و شرایط لازم برای واکنش ها را فراهم نمود.
2-1 تهیه محلول همگن (Homogeneous)
لازم است تا در ابتدا یک محلول همگن شامل حلال و پیش ماده هایی که قرار است در طول فرآیند، محصول نهایی را شکل دهند آماده گردد. برای این کار ابتدا حلال ( آب، الکل، حلال های آلی یا نسبتی از آنها ) و پیش ماده (Precursor) را در یک ظرف حل می کنیم تا محلول همگن حاصل شود. گاهی لازم است تا از ترکیب دو حلال با نسبت های معین استفاده شود تا پیش ماده ها به طور کامل در آن حل شود و محلول همگن حاصل شود. به عنوان مثال برخی از پیش ماده های آلی فلزی را ابتدا باید در یک حلال آلی قابل حل در آب حل کرد و سپس محلول حاصل را در آب حل نمود. اما در مواردی که پیش ماده مورد نظر نمک فلزی باشد به طور مستقیم در آب قابل حل بوده و نیازی به حلال آلی وجود ندارد.
پیش ماده های آلکوکسیدی بیشتر مورد استفاده قرار می گیرند اما می توان به طریق دیگری غیر از مسیر الکوکسیدی نیز روش سل – ژل را پیش برد که به آن مسیر کلوئیدی گفته می شود. راجع به مزایا و معایب هر کدام از دو مسیر بالا در مجالی دیگر به طور مفصل بحث خواهد شد.
آلکوکسیدهای فلزی به عنوان پیش ماده روش سل ژل یک دسته از خانوادة ترکیبات آلی فلزی می¬باشند که شامل یک بنیان آلی متصل به یک عنصر فلزی یا شبه فلزی می باشند . مثالی که اخیرا بسیار مورد مطالعه قرار گرفته تترا اتوکسید سیلسیم یا Si(OC2H5)4 می باشد. این پیش ماده با نام تترا اتوکسی سیلان (TEOS ) نیز شناخته می شود. در شکل زیر چند نمونه از آغازگرها متدوال برای سنتز اکسید سیلسیم آورده شده است.

پس از ساخت یک محلول همگن باید آن را به سل تبدیل کرد. می توان گفت که واکنش هیدرولیز (Hydrolysis) پایه این مرحله است. اصولا کلمه هیدرولیز از ترکیب دو کلمه هیدرو و لیز تشکیل شده و مفهوم آن تجزیه بوسیله آب است. اصطلاح تجزیه به هر موردی اطلاق می شود که یک حالت پیچیده به حالتی ساده تر تبدیل گردد. در شیمی گاهی آب می تواند مولکولی را شکسته و به مولکول های ساده تری تبدیل کند. به طور خلاصه به دسته ای از واکنش ها که در آن آب مولکولی را شکسته (بر اثر یک واکنش شیمیایی) و به مولکول های ساده تر تبدیل می کند اصطلاحا هیدرولیز می گوییم.


مهمترین نکته ای که راجع به یک سل خوب و قابل قبول باید گفت این است که سل حاصل باید به گونه¬ای تهیه شود تا بتواند برای ماه ها پایدار باشد و رسوب نکند. به عبارت دیگر باید اندازه ذرات آنقدر کوچک باشد که حرکات براونی (Brownian Motion) ذرات بر نیروی جادبه زمین غلبه کرده و ذرات ته نشین نشوند و و برای مدت طولانی همگن باقی بمانند. اگر سل حاصل دارای چنین ویژگی باشد می توان امیدوار بود تا محصولی همگن، خالص و با بازده بالا تولید شود.
2-3 تشکیل ژل
برای این کار کافی است، محلول ساخته شده را به نوعی تحریک کرده، تا ذرات ریز پراکنده شده (که هر کدام شامل چند تا چند ده واحد مولکولی یا اتمی از آغارگر های مربوطه هستند) شروع به نوعی گردهمایی کنند. با ایجاد بر همکنش های ( فیزیکی و شیمیایی ) میان ذرات معلق پراکنده شده در محلول سل، آنها به صورت واحد هایی متشکل از چند ده هزار مولکول کنار هم جمع شده و تشکیل یک مولکول سه بعدی بی نهایت بزرگ می دهند که نوعا تمام حجم ظرف واکنش را به خود اختصاص می دهد.



پخش انیمیشن آنلاین :
http://www.savosil.com/product/savosil/SiteCollectionImages/Stages/flash_movie_sivara-flash.swf
3 بحث و نتیجه گیری:
روش سل ژل، روش ارزان و قابل دسترس برای تولید در حجم صنعتی می باشد. در این روش با ساخت یک محلول سل خوب ( شفاف و پایدار ) و تبدیل آن به ژل طی فرآیند هیدرولیز و در پی آن تراکم به محصول ژل خیس رسیده و با یکی از روش هایی که برای خشک کردن ژل خیس وجود دارد، ژل را خشک کرده و به محصول نهایی که یک ساختار جامد متخلخل است می رسیم. نحوه خشک کردن بستگی مستقیم به نوع محصول و ویژگی های آن دارد. در مقاله دیگر به تفصیل به این موارد پرداخته خواهد شد.
فرمول شیمیایی آب
آب نوعی ماده مرکب است که از دو عنصر اکسیژن و هیدروژن ساخته شده است. آب را جزو دسته مخلوطها طبقهبندی نمیکنند، چون خواص آب نه به خواص هیدروژن شبیه است و نه به خواص اکسیژن. از ترکیب دو اتم هیدروژن و یک اتم اکسیژن، یک مولکول آب بوجود میآید. یک قطره آب دارای تعداد بی شماری مولکول آب میباشد.معادله شیمیایی واکنش بین هیدروژن و اکسیژن و تشکیل آب از قرار زیر است:
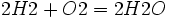
هر مولکول آب دارای یک ناحیه مثبت و یک ناحیه منفی است که این دو ناحیه در دو طرف مولکول آب واقع شدهاند. شیمیدانها با کمک شواهد به این نتیجه رسیدهاند که مولکول آب شکل خطی ندارد، یعنی به این صورت نیست که دو اتم هیدروژن بصورت خطی در دو طرف یک اتم اکسیژن قرار گرفته باشند (HــOــH). بلکه مولکول آب حالت خمیده ای دارد که اتم های هیدروژن در سر مثبت مولکول و اتم های اکسیژن در سر منفی مولکول آب تجمع پیدا نموده اند.